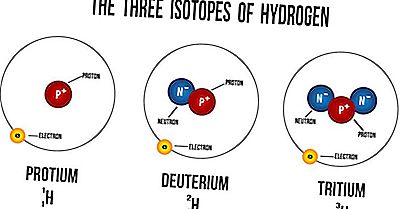
Qu'est-ce qu'un isotope?
Les isotopes sont des atomes du même élément qui ont un nombre égal de protons mais un nombre différent de neutrons. Leurs numéros atomiques sont les mêmes, mais leur nombre est différent. Les nombres de masse sont toujours désignés par A, tandis que Z désigne les numéros atomiques des éléments. Le numéro atomique symbolise le nombre de protons dans le noyau d'un atome et sert à identifier la position de l'élément sur le tableau périodique. Le nombre de masse d'un atome est le nombre de neutrons dans son noyau. Les isotopes des éléments ont des propriétés physiques différentes dues à la variation de leurs masses atomiques. En raison de cette différence, de tels isotopes ont des densités différentes, ainsi que des points de fusion et d'ébullition. Cependant, les isotopes d'un élément ont toujours des propriétés chimiques très similaires. La similarité se produit parce que seuls les électrons sont utilisés dans les réactions chimiques, pas les neutrons ou les protons.
Histoire des isotopes
Le radiochimiste Fredrick Soddy a d’abord suggéré l’existence d’isotopes dans 1913 après avoir mené des études sur la désintégration de chaînes radioactives. Au cours de ses expériences, Soddy a réalisé que quarante espèces différentes existaient entre le plomb et l'uranium, mais que le tableau périodique ne pouvait contenir que des atomes 11. Après que les tests chimiques menés pour séparer certains de ces éléments avaient échoué, il a suggéré que plusieurs types d’atomes puissent partager la même position dans le tableau périodique et les nommer isotopes.
Exemples d'isotopes
Le chlore contient deux isotopes majeurs: le chlore-35 et le chlore-37. Pour arriver à cette conclusion, les scientifiques ont découvert que dans une substance chlorée, des proportions de chacun de ces isotopes existent globalement, et c'est pourquoi les ratios sont utilisés pour exprimer la différence de quantité. Ces ratios sont utiles pour calculer les pourcentages relatifs et les masses atomiques relatives. D'autres exemples d'isotopes comprennent le carbone (isotopes de carbone-12 et carbone-14), l'oxygène (oxygène-16 et oxygène-18) et le phosphore (le phosphore-31 est l'isotope primaire, bien qu'il existe des quantités spécifiques de phosphore-32). Les isotopes de ces composés sont considérés comme stables et la plupart d'entre eux ne possèdent que deux isotopes. Cependant, quelques éléments ne contiennent qu'un seul isotope, à savoir le fluor, le béryllium, l'arsenic, l'yttrium, l'or, l'aluminium, l'iode, le manganèse, le sodium et le niobium.
Purification d'Isotopes
Il existe trois zones principales où les isotopes sont appliqués. Le premier est la séparation des isotopes. La séparation facilite la maximisation des propriétés des atomes selon les besoins. Dans la séparation d'éléments plus légers tels que le deutérium et l'oxygène, il y a l'application de la méthode de diffusion de gaz. La séparation des éléments lourds tels que l'uranium et le plutonium se fait par spectrométrie de masse.
Application des isotopes
La première application d'isotopes est son utilisation par les archéologues dans la datation au carbone. Les isotopes sont de deux types: les isotopes stables et radioactifs. Les isotopes stables contiennent une combinaison égale de protons et de neutrons et ne subissent donc pas de dégradation. D'autre part, les isotopes radioactifs ont des noyaux instables et subissent donc une dégradation. La décroissance radioactive peut durer aussi longtemps que 5,730, comme l'élément carbone. Les archéologues utilisent cette composante des isotopes pour déterminer l'âge d'un objet trouvé dans des fouilles archéologiques.








